- Produits
- Catalogues
- News & Trends
- Salons
Réactif IgG MO22196pour western blotpour immunofluorescencepour immunocytochimie
Ajouter à mes favoris
Ajouter au comparateur
Caractéristiques
- Type
- IgG
- Applications
- pour western blot, pour immunofluorescence, pour immunocytochimie
- Format
- liquide
- Marqueur testé
- PEA15
- Origine
- à partir de la souris
- Température de stockage
Min: -20 °C
(-4 °F)Max: 4 °C
(39 °F)
Description
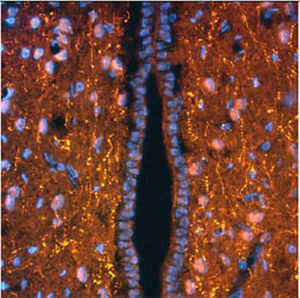
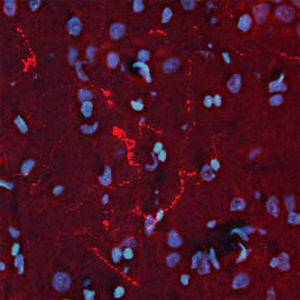
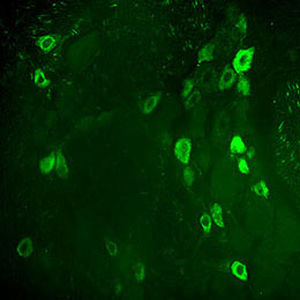
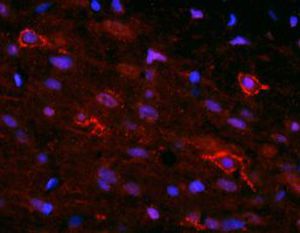
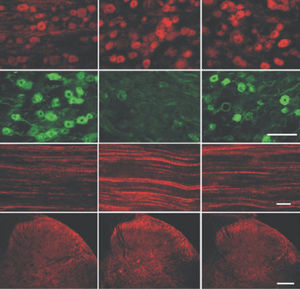
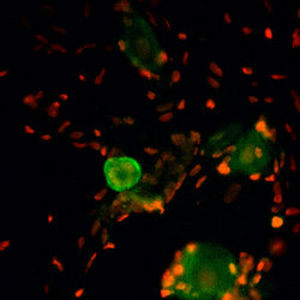
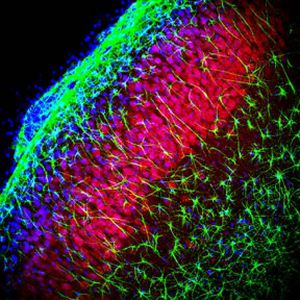
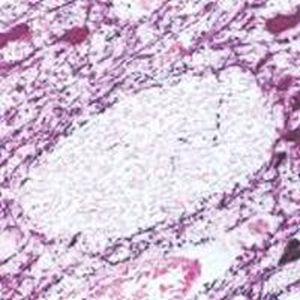
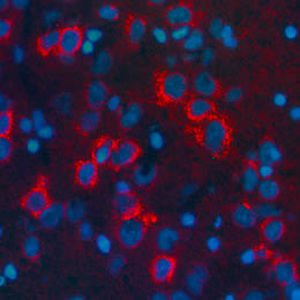
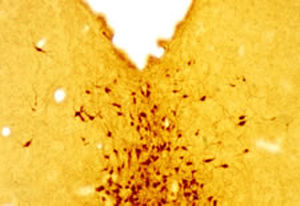
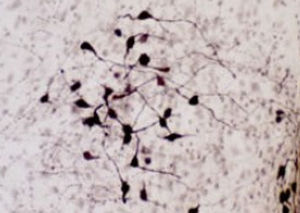
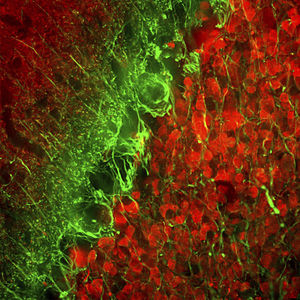
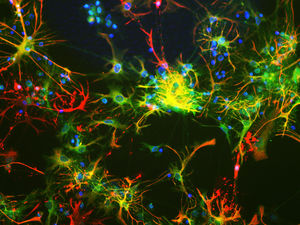
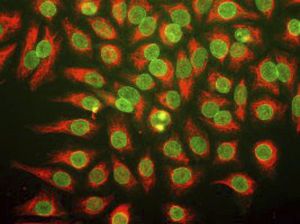
La PEA-15 a été isolée à l'origine comme une protéine majeure de faible poids moléculaire d'astrocytes striataux embryonnaires de souris cultivés en cellules. Trois taches sur des gels 2D avec un poids moléculaire apparent de 15kDa et un point isoélectrique de 5,1-5,3 se sont avérées être des formes différentes d'une seule protéine. La protéine a été phosphorylée sur un site par la protéine kinase C à la fois in vivo et in vitro et la protéine a été nommée "phosphoprotéine enrichie dans les astrocytes de 15kDa", d'où PEA-15. Le clonage et le séquençage ultérieurs ont révélé une protéine dont la séquence est bien conservée entre la souris et l'homme et qui est fortement exprimée dans le cerveau. Indépendamment, la même protéine s'est avérée être régulée à la hausse dans les fibroblastes et les tissus des patients diabétiques, et a donc été nommée "protéine enrichie dans le diabète" ou PED. Des études immunocytochimiques ont montré que la protéine était fortement exprimée dans les astrocytes et certains neurones du SNC des souris, bien qu'elle soit exprimée à des niveaux inférieurs de manière ubiquitaire. Il a été démontré que la PEA-15 interagit avec la kinase régulée par le signal extracellulaire et régule l'entrée nucléaire de cette protéine. Plusieurs autres interactions importantes avec d'autres protéines impliquées dans la régulation de l'apoptose, du métabolisme du glucose et de la croissance cellulaire ont été décrites. Le MCA-4D2 a été fabriqué contre une construction recombinante de PEA-15 de pleine longueur exprimée et purifiée à partir d'E. coli.
---
Catalogues
Aucun catalogue n’est disponible pour ce produit.
Voir tous les catalogues de NeuromicsRecherches associées
- Réactif pour biologie moléculaire
- Kit de réactifs pour la recherche
- Kit de réactifs de protéines
- Réactif pour immunologie
- Kit de réactifs anticorps
- Logiciel de laboratoire
- Kit de réactifs lyophilisé
- Kit de réactifs sérum
- Kit de réactifs pour immunohistochimie
- Kit de réactifs pour enzymes
- Kit de réactifs anticorps monoclonal
- Kit de réactifs pour western blot
- Réactif pour la recherche scientifique
- Logiciel pour la recherche
- Kit de réactifs pour immunofluorescence
- Anticorps polyclonal
- Kit de réactifs cytokine
- Kit de réactifs facteur de croissance
- Réactif à partir de la souris
- Réactif IgG
* Les prix s'entendent hors taxe, hors frais de livraison, hors droits de douane, et ne comprennent pas l'ensemble des coûts supplémentaires liés aux options d'installation ou de mise en service. Les prix sont donnés à titre indicatif et peuvent évoluer en fonction des pays, des cours des matières premières et des taux de change.