- Le Laboratoire
- Médecine de laboratoire
- Réactif sérum
- MP Biomedicals
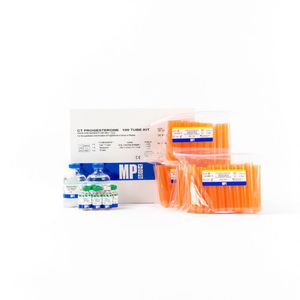
Kit de réactifs sérum 07171102plasmaanticorpsde diagnostic
Ajouter à mes favoris
Ajouter au comparateur
Caractéristiques
- Type
- sérum, plasma, anticorps
- Applications
- de diagnostic, clinique
Description
Le kit RIA double anticorps 17αOHP est destiné à la mesure de la 17α-hydroxyprogestérone dans le sérum ou le plasma non extrait d'adultes et d'enfants. Le stéroïde 17α-hydroxyprogestérone (17αOHP) est produit à la fois par le cortex surrénalien et les gonades. Même si la 17αOHP a une activité progestative relativement faible, elle présente un intérêt clinique intense car elle est le précurseur immédiat du 11-desoxycortisol (Cpd-S). Comme le Cpd-S est produit par 21-hydroxylation du 17αOHP, la mesure du 17αOHP est un indicateur indirect utile de l'activité de la 21-hydroxylase. Dans le cas d'un déficit congénital en 21-hydroxylase, la variété la plus courante d'hyperplasie congénitale des surrénales (HCS), le 17αOHP est sécrété en excès abondant. Elle est également modérément élevée dans le déficit en 11-b-hydroxylase. La mesure de la 17αOHP est donc précieuse dans le diagnostic initial de l'HCA.
Déclaration d'utilisation
Autorisé par la FDA pour le diagnostic in vitro (IVD) aux États-Unis. Marqué CE pour une utilisation IVD en dehors des États-Unis.
Principales applications
Endocrinologie
Analyte / Cible - 17OHP (17 alpha hydroxyprogestérone)
Numéro de catalogue de base - 171102
Plateformes de diagnostic - RIA
Solutions de diagnostic - Endocrinologie
Maladie dépistée - 17OHP
Évaluation - Quantitative
Taille du paquet - 100 Tubes
Type d'échantillon - Plasma, Sérum
Volume de l'échantillon - 25 uL
Réactivité de l'espèce - Humaine
Déclaration d'utilisation - Autorisé par la FDA pour le diagnostic in vitro (IVD) aux États-Unis. Marqué CE pour une utilisation IVD en dehors des États-Unis.
---
Catalogues
Aucun catalogue n’est disponible pour ce produit.
Voir tous les catalogues de MP BiomedicalsRecherches associées
- Kit d'analyse
- Kit de réactifs en solution
- Kit d'analyse de sang
- Réactif pour biologie moléculaire
- Kit d'analyse sérum
- Kit d'analyse par immunoanalyse
- Kit d'analyse plasma
- Kit de réactifs pour la recherche
- Kit d'analyse pour maladies infectieuses
- Test de diagnostic rapide de sang
- Kit de réactifs de protéines
- Kit de réactifs de diagnostic
- Kit de réactifs de laboratoire
- Test rapide à flux latéral
- Kit de réactifs enzyme
- Test rapide immunologique
- Kit de test moléculaire
- Test de diagnostic rapide cassette
- Test rapide pour virus
- Kit d'analyse de sang total
* Les prix s'entendent hors taxe, hors frais de livraison, hors droits de douane, et ne comprennent pas l'ensemble des coûts supplémentaires liés aux options d'installation ou de mise en service. Les prix sont donnés à titre indicatif et peuvent évoluer en fonction des pays, des cours des matières premières et des taux de change.