- Le Laboratoire
- Médecine de laboratoire
- Réactif solution de coloration
- BIO-OPTICA Milano
Réactif solution de coloration Luxol fast blue Kluwer Barrera pour histologiepour la cytologie
Ajouter à mes favoris
Ajouter au comparateur
Caractéristiques
- Type
- solution de coloration
- Applications
- pour histologie, pour la cytologie
Description
Nombre minimal de tests exécutables 100
Temps de réalisation 20 minutes + la nuit
Validité du produit 2 ans
Conditions de stockage 15-25°C
Équipement complémentaire Non requis
Application
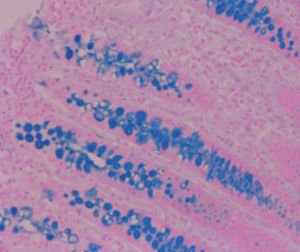
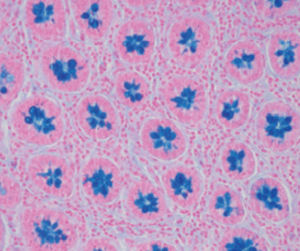
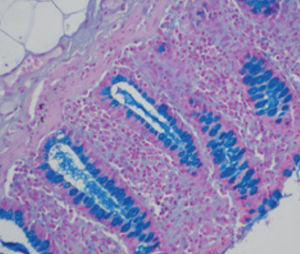
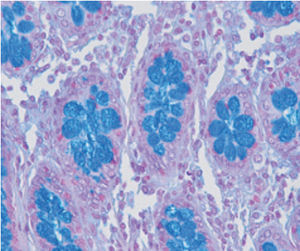
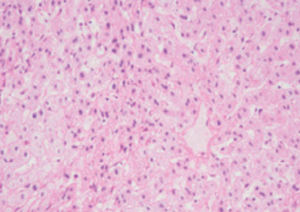
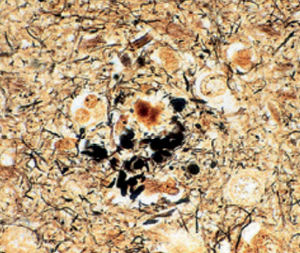
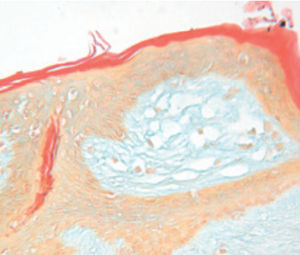
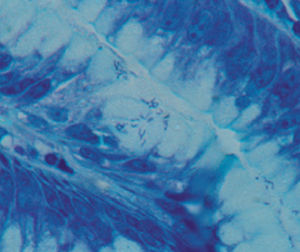
Méthode indiquée pour la démonstration de la myéline et des phospholipides sur des
coupes histologiques.
Résultat
Myéline bleu turquoise
Neurones et noyaux gliaux de rose à violet
Substance de Nissl rose pâle
Produit pour la préparation d'échantillons cyto-histologiques à examiner en microscopie optique.
Méthode indiquée pour la démonstration de la myéline et des phospholipides sur des coupes histologiques.
PRINCIPE
Le bleu de luxol rapide est un colorant chimiquement dérivé de la tétrabenzotétrazo-porphyrine. Klüver a démontré l’affinité sélective des porphyrines pour la myéline. On pense que l’électivité du colorant pour le système nerveux central est principalement due aux liaisons qu’il forme avec les structures phospholipidiques telles que la lécithine et la sphingomyéline. En utilisant cette méthode, il n’est pas nécessaire de chromer le tissu avant la coloration
MÉTHODE
1) Déparaffiner et amener la coupe à l’éthanol à 95°.
2) Préparer la chambre humide en mouillant le filtre placé dans la boîte de Petri avec de l’eau distillée, insérer la lame sur le
support et déposer ensuite 10 gouttes de réactif A sur la coupe ; fermer immédiatement le couvercle de la boîte et incuber
dans l’étuve à 56°C pendant une nuit.
3) Retirer la lame de la chambre humide et la laver à l’éthanol à 95° (les résidus cristallisés du réactif A doivent également se
dissoudre).
4) Laver dans de l'eau distillée.
5) Poser sur la coupe 10 gouttes de réactif B ; laisser agir 30 secondes.
Catalogues
Catalogue Gènèral
164 Pages
Recherches associées
- Réactif en solution Bio-Optica
- Kit de réactifs de laboratoire
- Réactif pour histologie Bio-Optica
- Kit de réactifs milieu réactionnel
- Réactif pour la cytologie Bio-Optica
- Réactif colorant Bio-Optica
- Kit de solution tampon
- Kit de réactifs pour bactéries
- Réactif solution de coloration Bio-Optica
- Lame de microscope
- Réactif pour préparation d'échantillons
- Réactif de pathologie
- Kit de réactifs de bilirubine
- Réactif solution de fixation Bio-Optica
- Réactif de cire de paraffine
- Réactif pour microscopie
- Kit de réactifs tampon phosphate
- Kit de réactifs collagène
- Kit de réactifs Helicobacter pylori
- Réactif solution décalcifiante
* Les prix s'entendent hors taxe, hors frais de livraison, hors droits de douane, et ne comprennent pas l'ensemble des coûts supplémentaires liés aux options d'installation ou de mise en service. Les prix sont donnés à titre indicatif et peuvent évoluer en fonction des pays, des cours des matières premières et des taux de change.